Télécharger notre présentation PowerPoint en cliquant-ici.
Environ 15% des couples qui essaient de concevoir un enfant pour la première fois n’y arrivent pas. La plupart des autorités définissent ces patients comme primairement infertiles s’ils n’ont pas été capables de concevoir après un an de rapports non protégés.
Normalement 80 à 85 % des couples, y parviennent au cours des douze mois qui suivent l’arrêt de la contraception.
Il faudrait considérer comme probablement infertiles et évaluer les personnes chez qui cela dure plus longtemps.
Des données disponibles ces 20 dernières années montrent que dans environ 30 % des cas, seul l’homme est responsable et que dans les autres 20%, l’homme ET la femme ont une fertilité réduite. C’est pourquoi le facteur mâle est en partie responsable d’au moins dans environ 50% des couples infertiles.
Premièrement nous faisons une différence entre l’infertilité et la fertilité réduite. On peut classer l’infertilité comme suit :
Dans de tels cas, il se peut que l’infertilité ne soit pas facile ou même impossible à guérir.
D’autre part, la fertilité réduite a des causes différentes et se manifeste souvent par une moindre mobilité des spermatozoïdes, des malformations, moins de sperme et d’autres facteurs provoquant la diminution de la qualité de la semence. De tels facteurs peuvent être :
Le contact avec des agents toxiques qui peuvent être gonadotoxiques ou antispermatogéniques. Il existe un grand nombre de ces substances avec lesquelles nous sommes en contact tous les jours, dans la vie de tous les jours ou dans la vie professionnelle. Ces substances touchent ainsi une proportion non négligeable de la population.
Le tabac et le tabagisme ont un effet délétère sur la numération, la mobilité et la morphologie des spermatozoïdes via une altération de la spermatogenèse. De plus, la fumée de cigarette est source de création de substances oxygénées activées (radicaux libres), néfastes pour les spermatozoïdes.
Actuellement il y a aussi une augmentation de la consommation de drogues soi‑disant récréatives (marijuana, cocaïne). Une consommation chronique d’alcool entraîne une diminution de la numération et du nombre de spermatozoïdes normaux. En cas d’alcoolisme, la fonction sexuelle est également altérée.
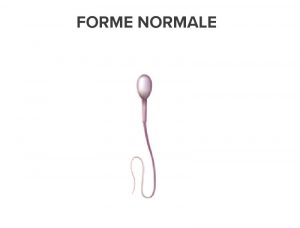
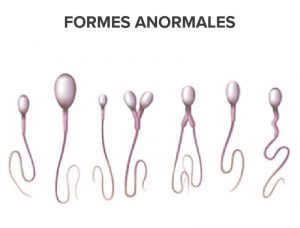
MORPHOLOGIE NORMALE ET FORMES ANORMALES
Les agents pharmacologiques affectent la fécondité en fonction de la dose utilisée et de la durée de leur prescription.
Les agents biologiques gonadotoxiques nous concernent de très près puisqu’ils touchent une grande partie de la gent masculine (par ex: augmentation de la température au niveau du scrotum. Cela peut être dû au port de pantalons trop étroits (les jeans par ex.) et au fait de rester assis très longtemps (travail de bureau, conducteurs de bus, de camion et de taxi, longs voyages en avion etc.)
Pour déterminer les critères biologiques qui définissent le statut de la fertilité masculine, l’OMS a établi des normes en matière d’analyse du sperme.
AINSI, SONT QUALIFIÉS PAR L’ OMS, COMME “NORMAUX”, LES PARAMÈTRES SUIVANTS :
| Volume de sperme par éjaculation | 2ml |
| Concentration en spermatozoïdes | 20 millions / ml |
| Mobilité des spermatozoïdes | 50% |
| Vitesse de progression des spermatozoïdes (sur une échelle de 0 à 4) | 3 |
| % de spermatozoïdes ayant une morphologie normale (valeur OMS) | 30% |
| Nombre total de spermatozoïdes | 40 millions |
| Nombre total de spermatozoïdes mobiles | 20 millions |
| Nombre total de spermatozoïdes fonctionnels | 6 millions |
Seuls les résultats d’un spermogramme peuvent déterminer s’il y a hypo-fertilité, fertilité normale ou encore hyper-fertilité.
Dans les cas d’hypo-fertilité confirmés par le spermogramme, plusieurs nutriments s’avèrent utiles pour augmenter les paramètres déficients.
FERTILHOM propose une association unique de ces nutriments utiles
| Composition nutritionnelle | Par jour (pour 1 sachet) |
|---|---|
| Fumarate de L‑carnitine | 2900 mg |
| Acétyl‑L‑carnitine | 500 mg |
| L‑Arginine | 250 mg |
| Glutathion | 100 mg |
| Co‑enzyme Q10 | 40 mg |
| Zinc | 7,5 mg |
| Vitamine B9 | 200 µg |
| Sélénium | 50 µg |
| Vitamine B12 | 2 µg |
Fertilhom fournit des nutriments utiles à la fertilité masculine: fumarate de L-carnitine, acétyl-L-carnitine, L-arginine, glutathion, coenzyme Q10, zinc, vitamine B9, sélénium, vitamine B12.

Le fumarate de L‑Carnitine et l’ Acétyl‑L‑carnitine sont les principaux composants de FertilHom. La carnitine est, d’un point de vue chimique, apparentée aux acides aminés, mais n’est pas constitutive des protéines. Elle sert de transporteur des acides gras vers leur site d’oxydation pour que ceux-ci subissent la 3-oxydation mitochondriale et fournissent ainsi l’énergie nécessaire à la mobilité des spermatozoïdes.
Il est observé chez des hommes hypofertiles, des corrélations entre la concentration en carnitine et la mobilité et la numération. Une supplémentation chez des sujets atteints d’asthénospermie idiopathique a permis, à raison de 3 g/j de carnitine pendant 3 et 4 mois, une augmentation de 10 % du nombre de spermatozoïdes mobiles et une augmentation de 8 % des spermatozoïdes ayant une progression linéaire rapide12-20,27,32,44-45.
L’arginine est un acide aminé non essentiel mais qui est nécessaire à la production d’un sperme de qualité. La production physiologique d’arginine diminue avec l’âge et un supplément d’arginine se révèle efficace chez les hommes plus âgés. Les études montrent qu’une supplémentation de plusieurs mois augmente la qualité et la quantité des spermatozoïdes8,9 et donc la fertilité10,11.
Le glutathion remplit sa fonction d’antioxydant. Les enzymes glutathion peroxidase/réductase jouent des rôles cruciaux pour combattre le stress oxydatif endommageant la qualité du sperme. Toute réduction des taux de glutathion réduit (GSH) lors de la spermatogenèse est clairement liée à des défauts d’intégrité de la membrane des spermatozoïdes 49-51.
Un autre antioxydant liposoluble, utile à la morphologie des spermatozoïdes, est la coenzyme Q10. Sa synthèse endogène requiert la présence de vitamines C, B2, B5, B6, B9 et B12 mais elle diminue progressivement avec l’âge après 25 ans.
L’ubiquinone est extrêmement concentrée dans les mitochondries de la partie intermédiaire des spermatozoïdes où elle a une double fonction : puissant antioxydant ET intermédiaire de la chaîne respiratoire. Le co-enzyme Q10 est donc indispensable à la production d’énergie des spermatozoïdes. Il remplit des fonctions vitales pour les spermatozoïdes. En effet, leur grande mobilité implique un besoin énorme en énergie. Le coenzyme Q10 aide à augmenter le nombre et la mobilité des spermatozoïdes24.
Un autre élément indispensable à la fonction reproductrice est le zinc. Dans le domaine de la fécondité, il est indispensable au développement testiculaire, à la spermatogenèse, à la mobilité des spermatozoïdes et à l’activité de la 5-α-réductase (enzyme nécessaire à la conversion de la testostérone en 5-α-dihydrotestostérone, forme biologiquement active de la testostérone). Tant chez le rongeur que chez l’homme, une déficience en zinc est connue depuis longtemps déjà comme cause d’oligospermie, de problèmes d’impuissance et d’hypogonadisme.5
Plusieurs études ont rapporté que chez les hommes présentant des problèmes de fertilité, les statuts en vitamines B9 et B12 étaient déficitaires.1-3,17,18
En effet, tout déficit en vitamine B12 est corrélé avec une perte de mobilité et un nombre réduit de spermatozoïdes. Aussi, lorsque l’acide folique (vitamine B9) est administré conjointement au zinc à des hommes hypofertiles, leur qualité de sperme est significativement meilleure par rapport à l’administration seule de soit vit B9, soit de zinc.22,46

REFERENCES BIBLIOGRAPHIQUES